

国家药监局官网刚刚发布一则公告,公告显示自4月1日起,出口新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计的企业向海关报关时必须提供国内医疗器械注册证明并符合进口国的质量标准要求。在近期海外注册法规较为混乱的背景下,此举可谓一锤定音!
那么此办法的用意何在、企业应该如何应对,请听详细介绍!
首先强调:当前最重要的事就是在国内拿证!否则国内国外都卖不了!
即使是医用口罩也要按照二类器械申请注册,其拿证周期和上市体考要求并不低。
CE和FDA可以缓一缓了,建议按照正规渠道申报,不要打擦边球了。
国内厂家尤其是跨界工厂必须正视医疗器械的合规要求。
相关产品必须经过有资质的机构检测,获得检测报告。
当前具备出口资质的产品见附件2,并且还要符合目标国家质量标准。
非医疗器械(如普通防护类口罩)不受此公告约束。
当前,全球疫情呈加速扩散蔓延态势。在做好自身疫情防控的基础上,有序开展医疗物资出口是深化疫情防控国际合作、共同应对全球公共卫生危机的重要举措。在疫情防控特殊时期,为有效支持全球抗击疫情,保证产品质量安全、规范出口秩序,自4月1日起,出口新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计的企业向海关报关时,须提供书面或电子声明(模版见附件1),承诺出口产品已取得我国医疗器械产品注册证书(相关注册信息见附件2),符合进口国(地区)的质量标准要求。海关凭药品监督管理部门批准的医疗器械产品注册证书验放。上述医疗物资出口质量监管措施将视疫情发展情况动态调整。
有关医疗物资出口企业要确保产品质量安全、符合相关标准要求,积极支持国际社会共同抗击疫情。
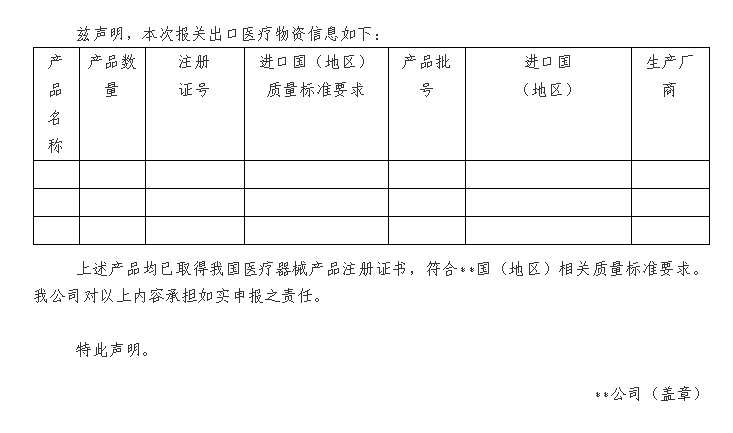
附件:1.出口医疗物资声明模版
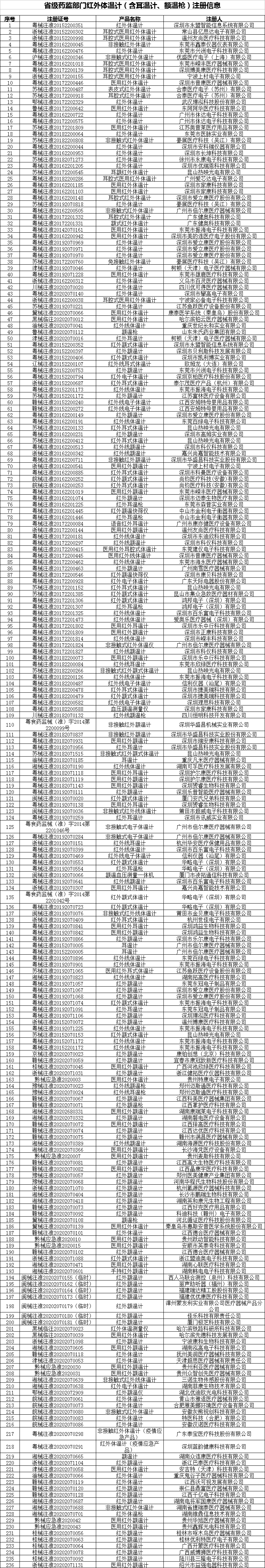
2.我国相关医疗器械产品注册信息(国家药监局网站www.nmpa.gov.cn动态更新)
商务部 海关总署 国家药品监督管理局
2020年 3月31日
附件1
出口医疗物资声明模板
附件2
相关器械注册信息
来源:NMPA

















